Bài tập xác định kim loại và cách giải
Bài tập xác định kim loại và cách giải
Với Bài tập xác định kim loại và cách giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập xác định kim loại từ đó đạt điểm cao trong bài thi môn Hoá 12.

A. Lý thuyết trọng tâm
- Kim loại kiềm khử nước dễ dàng ở nhiệt độ thường, giải phóng khí hiđro.
Ví dụ : 2K + 2H2O → 2KOH + H2 .
Tổng quát : 2A + 2H2O → 2AOH + H2
Từ Li đến Cs phản ứng xảy ra với nước ngày càng mãnh liệt. Natri bị nóng chảy và chạy trên mặt nước. Kali tự bùng cháy, rubiđi và xesi phản ứng mãnh liệt khi tiếp xúc với nước. Vì các kim loại kiềm dễ tác dụng với nước, với oxi trong không khí nên bảo quản, người ta ngâm chìm các kim loại kiềm trong dầu hỏa.
- Nhóm kim loại kiềm thổ: Be không khử được nước, Mg khử chậm nước khi có nhiệt độ cao, các kim loại còn lại khử mạnh nước ở nhiệt độ thường giải phóng khí H2.
Tổng quát : M + 2H2O → M(OH)2 + H2
B. Các dạng bài
Dạng 1: Xác định một kim loại dựa vào phản ứng
1. Phương pháp giải
Bước 1: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
- Công thức bảo toàn electron: ∑enhường = ∑enhận
- Công thức bảo toàn nguyên tố: Giả sử ta có hợp chất AxBy
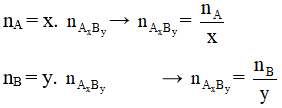
Chú ý: 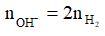
Bước 2: Tính nguyên tử khối theo công thức 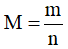 (g/mol), từ đó suy ra tên kim loại
(g/mol), từ đó suy ra tên kim loại
2. Ví dụ minh họa
Ví dụ 1: Hòa tan hết 4,68 gam kim loại kiềm M vào nước dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là
A. Rb.
B. Li.
C. K.
D. Na.
Lời giải chi tiết
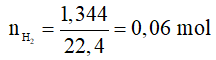
Phương trình hóa học:
2M + 2H2O → 2MOH + H2
Theo phương trình: 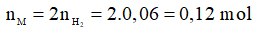
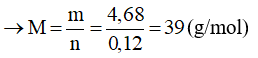
Vậy M là kim loại kali (K)
Chọn C.
Ví dụ 2: Cho 4,017 gam một kim loại kiềm X hòa tan vào nước dư được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 0,103 mol HCl. Kim loại X là
A. Na.
B. Li.
C. Rb.
D. K.
Lời giải chi tiết
Phương trình hóa học:
2X + 2H2O → 2XOH + H2 (1)
XOH + HCL → XCL + H2O (2)
Theo phương trình (2): nXOH = nHCl = 0,103 mol
Theo phương trình (1): nX = nXOH = 0,103 mol
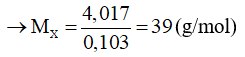
Vậy X là kim loại kali (K)
Chọn D.
Dạng 2: Xác định hai kim loại liên tiếp trong một nhóm bằng phương pháp trung bình
1. Phương pháp giải
Bước 1: Đặt công thức chung của hai kim loại là R.
Bước 2: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
Bước 3: Tính phân tử khối trung bình theo công thức 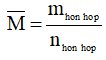 , từ đó kết hợp với điều kiện của bài toán suy ra tên kim loại
, từ đó kết hợp với điều kiện của bài toán suy ra tên kim loại
- Nếu dung dịch bazơ tạo thành sau khi phản ứng với nước được trung hòa bởi H+ thì ta có:
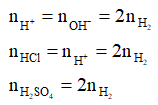
- Nếu dung dịch bazơ tạo thành sau khi phản ứng với nước kết tủa với các cation kim loại thì viết phương trình ion và tính.
2. Ví dụ minh họa
Ví dụ 1: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng nhóm IA. Lấy 6,2 gam X hòa tan hoàn toàn vào nước thu được 2,24 lít hiđro (đktc). A, B là
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Lời giải chi tiết
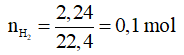
Đặt công thức chung của A và B là M
Phương trình phản ứng:
2M + 2H2O → 2MOH + H2
Theo phương trình: 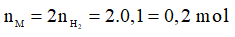
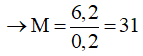
Vậy hai kim loại là Na và K
Chọn B.
Ví dụ 2: A là hỗn hợp hai kim loại kiềm X và Y thuộc hai chu kì kế tiếp. Nếu cho A tác dụng vừa đủ với dung dịch HCl thì thu được a gam hai muối, còn nếu cho A tác dụng vừa đủ với dung dịch H2SO4 thì thu được 1,1807a gam hai muối. X và Y là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Lời giải chi tiết
Đặt công thức chung của hai kim loại kiềm là R, khối lượng mol trung bình của chúng là
Chọn số mol của R tham gia phản ứng là 1 mol
Phương trình phản ứng:
2R + 2HCL → 2RCL + H2 (1)
2R + H2SO4 → R2SO4 + H2 (2)
Theo phương trình (1): nRCL = nR = 1 mol
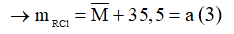
Theo phương trình (2): 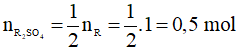
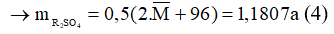
Từ (3) và (4) ta có 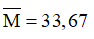
Nhận xét: 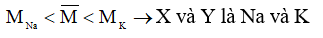
Chọn B.
C. Bài tập tự luyện
Câu 1: Cho 0,39 gam một kim loại kiềm X vào nước, thu được 0,112 lít khí H2 (ở đktc). Kim loại kiềm X là
A. Na.
B. K.
C. Li.
D. Cs.
Câu 2: Hòa tan hết 1,4 gam kim loại kiềm X vào 200 gam nước, thu được dung dịch có khối lượng là 201,2 gam. Kim loại kiềm X là
A. Rb.
B. Na.
C. K.
D. Li.
Câu 3: Hòa tan hết 1,15 gam kim loại X vào dung dịch HCl, thu được 0,56 lít khí (ở đktc). Kim loại X là
A. Na.
B. Ba.
C. K.
D. Ca.
Câu 4: Cho 0,3 gam hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau vào nước, thu được 0,112 lít khí H2 (ở đktc). Hai kim loại kiềm là
A. Li, Na.
B. Na, K.
C. Li, K.
D. K, Cs.
Câu 5: Hòa tan hết 0,3 gam hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau vào dung dịch HCl dư, thu được 0,224 lít khí (ở đktc). Hai kim loại kiềm là
A. Li, Na.
B. Na, K.
C. K, Cs.
D. Li, K.
Câu 6: Đốt cháy hoàn toàn 4,6 gam kim loại kiềm X trong khí clo dư, thu được 11,7 gam muối. Kim loại kiềm X là
A. Na.
B. Li.
C. K.
D. Cs.
Câu 7: Cho 5,3 gam muối M2CO3 tác dụng với dung dịch HCl dư, thu được 1,12 lít khí ở đktc. Muối M2CO3 là
A. Na2CO3.
B. Li2CO3.
C. K2CO3.
D. Cs2CO3.
Câu 8: Hòa tan hoàn toàn 6,645 gam hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được 18,655 gam kết tủa. Hai kim loại kiềm trên là
A. Rb và Cs.
B. Na và K.
C. Li và Na.
D. K và Rb.
Câu 9: Hòa tan hết 0,897 gam kim loại X vào 4,459 ml nước tạo ra dung dịch kiềm có nồng độ 29,34%. Biết khối lượng riêng của nước là 1 g/ml. Kim loại X là
A. Na.
B. Ba.
C. K.
D. Ca.
Câu 10: Cho 3,6 gam hỗn hợp X gồm K và một kim loại kiềm M tác dụng vừa hết với nước, thu được 2,24 lít H2 ở 0,5 atm và 00C. Biết số mol kim loại M trong hỗn hợp lớn hơn 10% tổng số mol hai kim loại. M là kim loại
A. K.
B. Na.
C. Li.
D. Rb.
Câu 11: Cho 1,5 gam hỗn hợp Na và kim loại kiềm A tác dụng với nước thu được 1,12 lít H2 (đktc). A là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 12: Cho 4,9 gam kim loại kiềm M vào một cốc nước. Sau một thời gian lượng khí thoát ra đã vượt quá 7,5 lít (đktc). Kim loại kiềm M là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 13: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong nhóm IA. Lấy 7,2 gam X hòa tan hoàn toàn vào nước thu được 4,48 lít hiđro (đktc). A, B là hai kim loại nào?
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Câu 14: Hai kim loại kiềm A và B nằm trong hai chu kì liên tiếp nhau trong bảng tuần hoàn các nguyên tố hóa học. Hòa tan hai kim loại này vào nước thu được 0,336 lít khí (đktc) và dung dịch C. Cho HCl dư vào dung dịch C thu được 2,075 gam muối, hai kim loại đó là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Li và K.
Câu 15: Cho hỗn hợp X gồm Na và một kim loại kiềm có khối lượng 6,2 gam tác dụng với 104 gam nước thu được 100 ml dung dịch có khối lượng riêng bằng 1,1 g/ml. Biết hiệu số hai khối lượng nguyên tử < 20. Kim loại kiềm là
A. Li.
B. K.
C. Rb.
D. Cs.
Câu 16: Có x mol hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp (hỗn hợp X). X tác dụng vừa đủ với dung dịch HCl thu được a gam hỗn hợp muối clorua khan, còn nếu cho X tác dụng vừa đủ với dung dịch H2SO4 thì thu được b gam hỗn hợp muối sunfat khan. Giá trị của x là
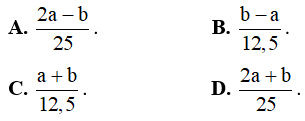
Câu 17: Cho từ từ dung dịch HCl có pH = 0 vào dung dịch chứa 5,25 gam hỗn hợp muối cacbonat của 2 kim loại kiềm kế tiếp đến khi có 0,015 mol khí thoát ra thì dừng lại. Cho dung dịch thu được tác dụng với dung dịch Ca(OH)2dư sinh ra 3 gam kết tủa. Công thức của 2 muối và thể tích dung dịch HCl đã dùng là
A.Li2CO3và Na2CO3; 0,03 lít.
B.Na2CO3và K2CO3; 0,03 lít.
C.Li2CO3và Na2CO3; 0,06 lít.
D.Na2CO3và K2CO3; 0,06 lít.
Câu 18: Hoà tan hoàn toàn 27,4 gam hỗn hợp gồm M2CO3và MHCO3(M là kim loại kiềm) bằng dung dịch HCl dư thấy thoát ra 6,72 lít CO2(đktc). Kim loại M là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 19: Cho 17 gam hỗn hợp X gồm hai kim loại kiềm đứng kế tiếp nhau trong nhóm IA tác dụng với nước thu được 6,72 lít H2(đktc) và dung dịch Y. Hỗn hợp X gồm
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Câu 20: Cho 6,2 gam hỗn hợp 2 kim loại kiềm tác dụng hết với nước thấy có 2,24 lít H2(đktc) bay ra. Cô cạn dung dịch thì khối lượng chất rắn khan thu được là
A. 9,4 gam.
B. 9,5 gam.
C. 9,6 gam.
D. 9,7 gam.
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
B |
D |
A |
B |
A |
A |
A |
C |
A |
B |
Câu 11 |
Câu 12 |
Câu 13 |
Câu 14 |
Câu 15 |
Câu 16 |
Câu 17 |
Câu 18 |
Câu 19 |
Câu 20 |
A |
A |
A |
B |
B |
B |
D |
B |
B |
C |

