Các dạng toán cho hỗn hợp kim loại kiềm, kim loại kiềm thổ, nhôm tác dụng với nước và cách giải
Các dạng toán cho hỗn hợp kim loại kiềm, kim loại kiềm thổ, nhôm tác dụng với nước và cách giải
Với Các dạng toán cho hỗn hợp kim loại kiềm, kim loại kiềm thổ, nhôm tác dụng với nước và cách giải Hoá học lớp 12 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập toán cho hỗn hợp kim loại kiềm, kim loại kiềm thổ, nhôm tác dụng với nước từ đó đạt điểm cao trong bài thi môn Hoá 12.

A. Lý thuyết trọng tâm
Al2O3 là oxit lưỡng tính nên lớp màng mỏng Al2O3 trên bề mặt nhôm tác dụng với dung dịch kiềm tạo ra muối tan. Khi không còn màng oxit bảo vệ, nhôm sẽ tác dụng với nước tạo ra Al(OH)3 và giải phóng khí H2 ; Al(OH)3 là hiđroxit lưỡng tính nên tác dụng trực tiếp với dung dịch kiềm.
- Al tham gia phản ứng dễ dàng với các dung dịch kiềm:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
- Cơ chế: + Trước tiên, Al tham gia phản ứng với nước:
2Al + 6H2O → 2Al(OH)3 + 3H2
+ Al(OH)3 sinh ra là hiđroxit lưỡng tính tan được trong dung dịch kiềm:
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Quá trình này lặp đi lặp lại đến hết.
B. Phương pháp giải
Khi cho hỗn hợp Al và kim loại (Na, K, Ba) vào nước hay vào dung dịch kiềm:
Trước tiên có phản ứng: 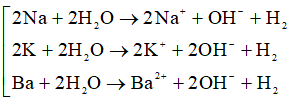
Sau đó xảy ra phản ứng: 2Al + 2H2O + 2OH-→ 2AlO2- + 3H2
Cách 1: Tính theo phương trình hóa học (chú ý phải xét Al hết hay Al dư)
Cách 2: Sử dụng công thức tính nhanh.
Cho hỗn hợp vào nước:
+ Nếu Al dư, khi đó OH- hết, khi đó: 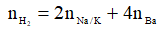
+ Nếu Al hết, OH- dư: 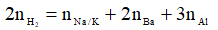
Cho hỗn hợp vào dung dịch kiềm dư (Al hết): 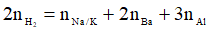
C. Ví dụ minh họa
Ví dụ 1: Cho m gam hỗn hợp Na, Al vào nước, thu được 0,4 mol H2. Nếu cho m gam hỗn hợp trên vào dung dịch NaOH dư, thì thu được 0,7 mol H2. Giá trị của m là
A. 18,4.
B. 15,4.
C. 19,1.
D. 10,8.
Lời giải chi tiết
Trong hai thí nghiệm lượng chất ban đầu như nhau, nhưng số mol khí H2 thu được ở thí nghiệm (2) lớn hơn ở thí nghiệm (1), chứng tỏ ở thí nghiệm (1) nhôm phải dư.
Gọi số mol của Na và Al lần lượt là x và y mol
Cho hỗn hợp vào nước (Al dư)
2Na + 2H2O → 2Na+ + 2OH- + H2
X → x → x
2Al + 2H2O + 2OH- → 2AlO2- + 3H2
x ← x → 1,5x

Cho hỗn hợp vào dung dịch NaOH dư (Al hết)
2Na + 2H2O → 2Na+ + 2OH- + H2
0,2 → 0,1
2Al + 2H2O + 2OH- → 2AlO2- + 3H2
y → 1,5y
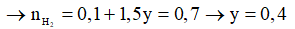
→ m = 0,2.23 + 0,4.27 = 15,4 gam
Chọn B.
Ví dụ 2: Cho m gam hỗn hợp Ba và Al vào nước dư sau khi các phản ứng xảy ra hoàn toàn thu được 7,168 lít khí H2 (đktc) và 3,08 gam chất rắn không tan. Giá trị của m là
A. 14,32.
B. 18,36.
C. 15,28.
D. 17,02.
Lời giải chi tiết
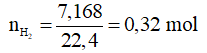
Chất rắn không tan là Al dư
Gọi số mol Ba trong hỗn hợp ban đầu là x mol
Phương trình hóa học:
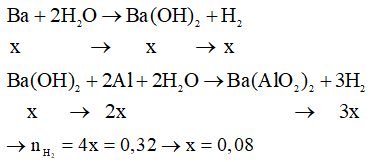
Theo phương trình: nAl phản ứng = 2x = 0,16 mol
→ mAl phản ứng = 4,32 gam
→ m = mBa + mAl phản ứng + mAl dư = 0,08.137 + 4,32 + 3,08 = 18,36 gam
Chọn B.
Ví dụ 3: Hỗn hợp X gồm Na, Al và Fe (với tỉ lệ số mol giữa Na và Al tương ứng là 2:1). Cho X tác dụng với H2O dư thu được chất rắn Y và V lít khí. Cho toàn bộ Y tác dụng với dung dịch H2SO4 loãng dư thu được 0,25V lít khí. Biết các khí đo ở cùng điều kiện, các phản ứng đều xảy ra hoàn toàn. Tỉ lệ số mol của Fe và Al trong X tương ứng là
A. 16:5.
B. 5:16.
C. 1:2.
D. 5:8.
Lời giải chi tiết
Cho X (Na, Al, Fe) tác dụng với H2O dư:
Gọi số mol khí H2 là x mol
Vì tỉ lệ số mol Na:Al = 2:1
→ Khi cho X vào nước thì Al và Na đều hết, Fe không phản ứng
→ Chất rắn Y là Fe
Ta có: nAl = a mol → nNa = 2a mol
Bảo toàn electron: 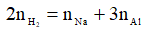
→ 3a + 2a = 2x → nAl = a = 0,4x mol
Cho Y tác dụng với H2SO4 loãng dư:
Ta có: 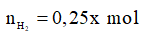
Bảo toàn electron: 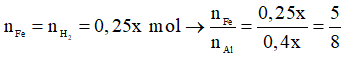
Chọn D.

D. Bài tập tự luyện
Câu 1: Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là
A. 3,70.
B. 4,85.
C. 4,35.
D. 6,95.
Câu 2: Hòa tan hết 13,275 gam hỗn hợp gồm BaO và Al vào nước thu được dung dịch X. Sục CO2 dư vào X, thu được 7,41 gam kết tủa. Phần trăm khối lượng BaO trong hỗn hợp là
A. 80,876%.
B. 78,806%.
C. 70,688%.
D. 80,678%.
Câu 3: Cho hỗn hợp Na và Al có tỉ lệ số mol tương ứng là 1:2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn thu được 0,896 lít khí H2 (ở đktc) và m gam chất rắn không tan. Giá trị của m là
A. 0,78
B. 0,54
C. 4,32
D. 1,08
Câu 4: Cho 8,6 gam hỗn hợp K, Fe, Mg và Al vào nước. Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí H2 (đktc) và m gam ba kim loại không tan. Giá trị của m là
A. 2,7
B. 2,0
C. 4,0
D. 3,6
Câu 5: Hỗn hợp X gồm K, Mg, Al. Chia X thành ba phần bằng nhau. Phần một cho vào dung dịch HCl dư, thu được 2,016 lít khí. Phần hai cho vào nước dư, thu được 0,896 lít khí. Phần ba cho vào dung dịch NaOH dư, thu được 1,568 lít khí. Biết các phản ứng xảy ra hoàn toàn, các khí đo ở đktc. Phần trăm khối lượng Al trong X là
A. 46,15%
B. 33,33%
C. 45,25%
D. 35,54%
Câu 6: Hỗn hợp X gồm Al, Na. Cho m gam X vào nước chỉ thu được V lít khí H2. Nếu cho m gam vào dung dịch NaOH dư, thì thu được 1,75V lít khí H2. Các thể tích khí đo ở cùng điều kiện, các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Na trong X là
A. 77,31%
B. 39,87%
C. 49,87%
D. 29,87%
Câu 7: Hỗn hợp X gồm Ba, Al. Chia m gam X thành hai phần bằng nhau: Phần một cho vào nước dư, thu được 1,344 lít khí. Phần hai cho vào dung dịch Ba(OH)2 dư, thu được 2,016 lít khí. Biết các phản ứng xảy ra hoàn toàn, các khí đo ở đktc. Giá trị của m là
A. 3,405
B. 6,810
C. 5,190
D. 4,565
Câu 8: Hỗn hợp X gồm Ba, Na và Al, trong đó số mol của Al bằng 6 lần số mol của Ba. Cho m gam X vào nước đến phản ứng hoàn toàn, thu được 1,792 lít khí H2 (đktc) và 0,54 gam chất rắn, Giá trị của m là
A. 3,90
B. 5,27
C. 3,45
D. 3,81
Câu 9: Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau: Cho phần một vào dung dịch KOH dư thu đươc 0,784 lít khí H2 (đktc). Cho phần hai vào một lượng dư H2O thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl dư thu được 0,56 lít khí H2 (đktc). Khối lượng của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là
A. 0,39 gam; 0,54 gam; 1,40 gam
B. 0,78 gam; 1,08 gam; 0,56 gam
C. 0,39 gam; 0,54 gam; 0,56 gam
D. 0,78 gam; 0,54 gam; 1,12 gam
Câu 10: Hòa tan hoàn toàn m gam hỗn hợp X gồm Na và Al vào nước dư, thu được dung dịch Y. Chia Y là ba phần bằng nhau: Cho từ từ dung dịch HCl 1M vào phần một đến khi bắt đầu xuất hiện kết tủa thì dùng hết 100 ml. Cho từ từ 450 ml dung dịch HCl 1M vào phần hai, thu được 3a gam kết tủa. Cho từ từ 750 ml dung dịch HCl 1M vào phần ba, thu được a gam kết tủa. Giá trị của m là
A. 44,40
B. 28,50
C. 40,65
D. 36,90
ĐÁP ÁN
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
B |
D |
B |
B |
A |
D |
B |
C |
C |
A |

