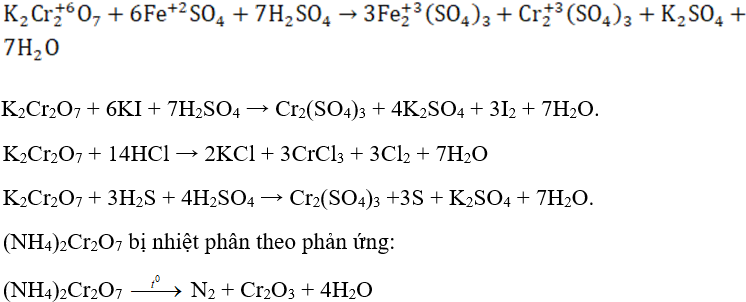Lý thuyết Hợp chất của Crom hay, chi tiết nhất - Hoá học lớp 12
Lý thuyết Hợp chất của Crom hay, chi tiết nhất
Tài liệu Lý thuyết Hợp chất của Crom hay, chi tiết nhất Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về Hợp chất của Crom từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

I. CROM (II)
1. Oxit CrO
- CrO là một oxit bazơ, màu đen
- CrO có tính khử, trong không khí CrO dễ bị oxi hóa thành Cr2O3.
- CrO tan dễ dàng trong dung dịch HCl loãng; H2SO4 loãng
CrO + 2HCl → CrCl2 + H2O
CrO + H2SO4 → CrSO4 + H2O
- CrO có tính khử, trong không khí CrO dễ bị oxi hóa thành Cr2O3.
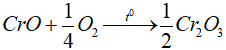
2. Hidroxit Cr(OH)2
- Cr(OH)2 là chất rắn, màu vàng.
- Cr(OH)2 có tính khử, trong không khí oxi hóa thành Cr(OH)3
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Cr(OH)2 là một bazơ.
Cr(OH)2 + 2HCl → CrCl2 + H2O
3. Muối crom (II)
- Muối crom (II) có tính khử mạnh.
4CrCl2 + O2 + 4HCl → 4CrCl3 + 2H2O
- Dung dịch CrCl2 để ngoài không khí lại chuyển từ màu xanh lam sang màu lục
- CrCl2 trong dung dịch phân ly ra Cr2+ và Cl-. Ion Cr2+ tồn tại ở dạng [Cr(H2O)]2+ có màu xanh, nên dung dịch CrCl2 có màu xanh.
- Mặt khác trạng thái oxi hóa +2 của Cr có tính khử mạnh, ngay trong dung dịch CrCl2 bị oxi hóa bởi oxi không khí chuyển thành CrCl3. Ion Cr3+ trong dung dịch tồn tại dưới dạng [Cr(H2O)]3+ có màu lục. Nên trong không khí CrCl2 chuyển từ màu xanh lam sang màu lục.
II. CROM (III)
1. Oxit Cr2O3
- Crom (III) oxit: Cr2O3 là oxit lưỡng tính, tan trong axit và kiềm đặc.
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4]
- Được dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
2. Hidroxit Cr(OH)3
- Crom (III) hiđroxit: Cr(OH)3 là một hiđroxit lưỡng tính, kết tủa nhầy, màu lục nhạt, tan được trong dung dịch axit và dung dịch kiềm.
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
- Bị phân huỷ bởi nhiệt tạo oxit tương ứng:
2Cr(OH)3 → Cr2O3 + 3H2O
Chú ý: vì ở trạng thái số oxi hóa trung gian, ion Cr3+ trong dung dịch vừa có tính oxi hóa (trong môi trường axit) vừa có tính khử (trong môi trường bazơ)
Cr3+ + Zn → 2Cr2+ + Zn2+
2CrO2- + 3Br2 + 8OH- → 2CrO42- + 6Br- + 4H2O
3. Muối crom (III)
- Muối crom (III) có tính khử và tính oxi hóa.
- Muối Cr(III): CrCl3 màu tím, Cr2(SO4)3 màu hồng.
Chú ý: khi vào dung dịch, muối Cr(III) có màu tím - đỏ ở nhiệt độ thường và màu lục khi đun nóng.
- Trong môi trường axit, muối crom (III) có tính oxi hóa bị Zn khử thành muối crom (II)
2Cr3+(dd) + Zn → 2Cr2+ + Zn2+(dd)
Ví dụ:
2CrCl3 + Zn → 2CrCl2 + ZnCl2
Cr2(SO4)3 + Zn → 2CrSO4 + ZnSO4
- Trong môi trường kiềm, muối crom (III) có tính khử và bị chất oxi hóa mạnh oxi hóa thành muối crom (VI).
2Cr3+(dd) + 3Br2 → 2Cr6+(dd) + 2Br-(dd)
Ví dụ:
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
Cr2(SO4)3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 3K2SO4 + 8H2O
2Cr(NO3)2 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KNO3 + 8H2O
- Phèn crom - kali K2SO4.Cr2(SO4)3.24H2O có màu xanh tính, được dùng để thuộc da, làm chất cầm màu trong ngành nhuộm vải.
III. CROM (VI)
1. Oxit CrO3
- CrO3 là một oxit axit, tác dụng với nước tạo ra axit:
CrO3 + H2O → H2CrO4: axit cromic
2CrO3 + H2O → H2Cr2O7: axit đicromic
- CrO3 có tính oxi hóa mạnh, một số chất vô cơ và hữu cơ như S, P, C, C2H5OH bốc cháy khi tiếp xúc với CrO3.
2. Muối crom (VI)
Muối cromat: natri cromat (Na2CrO4) và kali cromat (K2CrO4) là muối của axit cromic, có màu vàng của ion cromat (CrO42-).
Muối đicromat: natri cromat (Na2Cr2O7) và kali đicromat (K2Cr2O7) là muối của axit đicromat, có màu da cam của ion đicrom (Cr2O72-).
- Trong môi trường axit, cromat chuyển hóa thành đicromat.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
- Trong môi trường kiềm đicromat chuyển hóa thành cromat.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Các muối cromat và đicromat có tính oxi hóa mạnh, muối crom (VI) bị khử thành muối crom (III).