Lý thuyết về tính chất của crom, sắt và hợp chất hay, chi tiết - Hoá học lớp 12
Lý thuyết về tính chất của crom, sắt và hợp chất hay, chi tiết
Tài liệu Lý thuyết về tính chất của crom, sắt và hợp chất hay, chi tiết Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về tính chất của crom, sắt và hợp chất từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

A. CROM VÀ HỢP CHẤT CỦA CROM
I. Tính chất vật lý, cấu tạo
- Crom có màu trắng ánh bạc, rất cứng (cứng nhất trong số các kim loại), khó nóng chảy (1890oC).
- Crom là kim loại nặng, có khối lượng riêng 7,2 g/cm3.
- Crom có số hiệu nguyên tử là 24, thuộc nhóm VIB, chu kì 4.
- Có các số oxi hóa là +2, +3, +6.
II. Tính chất hóa học
1. Crom
- Tác dụng với phi kim
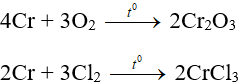
- Bền với nước và không khí do có màng oxit vững chắc bảo vệ.
- Tác dụng với axit:
+ Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr (II).
Cr + 2HCl → CrCl2 + H2
+ Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
Chú ý: Crom không tan được trong dung dịch NaOH loãng cũng như dung dịch NaOH đặc nóng.
2. Một số hợp chất của Crom
- Cr2O3: là những oxit lưỡng tính, tan được trong dung dịch axit và kiềm đặc.
- Cr(OH)3 là hiđroxit lưỡng tính, được điều chế từ muối Crom (III) và dung dịch kiềm.
- CrO3: là một oxit có tính axit, có tính oxi hóa rất mạnh.
- Muối cromat và đicromat: đều có tính oxi hóa mạnh
+ Trong môi trường axit, cromat chuyển hóa thành đicromat.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
+ Trong môi trường kiềm đicromat chuyển hóa thành cromat.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
B. SẮT VÀ HỢP CHẤT CỦA SẮT
I. Tính chất vật lý, cấu tạo
- Sắt có Z = 26 thuộc nhóm VIIIB, chu kì 4 của bảng tuần hoàn.
- Cấu hình electron của Fe: [Ar]3d64s2; Fe2+: [Ar]3d6; Fe3+: [Ar]3d5.
- Số oxi hóa: +2, +3.
- Có màu trắng, hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC, D = 7,9 g/cm3, dẫn điện, dẫn nhiệt tốt, có tính nhiễm từ.
II. Tính chất hóa học
1. Sắt
Tính khử trung bình (tác dụng với oxi, lưu huỳnh, clo, nước, dung dịch axit, dung dịch muối).
+ Với chất oxi hóa yếu: Fe → Fe2+ + 2e.
+ Với chất oxi hóa mạnh: Fe → Fe3+ + 3e.
+ Fe thụ động với H2SO4 và HNO3 đặc nguội.
Một số phương trình minh họa
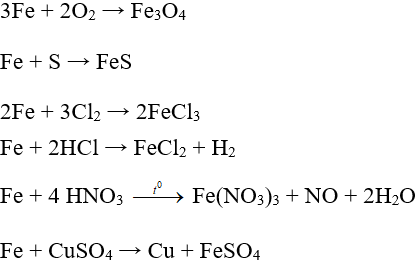
2. Hợp kim của sắt
a. Gang
- Gang là hợp kim của sắt với cacbon, trong đó C chiếm 2 – 5% về khối lượng.
- Phân loại: Gang trắng và gang xám.
- Nguyên tắc luyện gang: khử oxit sắt trong quặng thành sắt.
- Các phương trình hóa học:
Tạo chất khử: C + O2 → CO2 và C + CO2 → 2CO.
Quá trình khử: Fe2O3 → Fe3O4 → FeO → Fe.
Loại tạp chất trong quặng:
CaCO3 → CaO + CO2
CaO + SiO2 → CaSiO3
b. Thép
- Là hợp kim của sắt với C trong đó C chiếm 0,01 – 2% về khối lượng.
- Phân loại: thép thường và thép đặc biệt.
- Nguyên tắc luyện gang thành thép: loại bỏ phần lớn các nguyên tố C, Si, Mn, S, … ra khỏi gang bằng cách oxi hóa chúng và chuyển thành xỉ.
- Các phương trình hóa học:
C + O2 → CO2;
S + O2 → SO2;
Si + O2 → SiO2;
4P + 5O2 → 2P2O5 (xỉ);
CaO + SiO2 → CaSiO3;
3CaO + P2O5 → Ca3(PO4)3 (xỉ).
- Phương pháp luyện thép: phương pháp Bet-xơ-me (lò thổi oxi); phương pháp Mac-tanh (lò bằng); phương pháp lò điện.
- Gang và thép được sử dụng rất phổ biến trong các ngành công nghiệp và đời sống.

