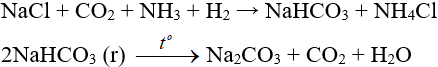Lý thuyết về các hợp chất quan trọng của kim loại kiềm hay, chi tiết nhất - Hoá học lớp 12
Lý thuyết về các hợp chất quan trọng của kim loại kiềm hay, chi tiết nhất
Tài liệu Lý thuyết về các hợp chất quan trọng của kim loại kiềm hay, chi tiết nhất Hoá học lớp 12 sẽ tóm tắt kiến thức trọng tâm về các hợp chất quan trọng của kim loại kiềm từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 12.

I. Natri hiđroxit, NaOH
1. Tính chất vật lý
+ NaOH là chất rắn màu trắng, dễ hút ẩm, dễ nóng chảy, tan nhiều trong nước.
+ NaOH là bazơ mạnh, trong dung dịch NaOH → Na+ + OH-.
2. Tính chất hóa học: Là bazơ mạnh (hay còn gọi là kiềm hay chất ăn da); làm quỳ tím hóa xanh, phenolphtalein hóa hồng. NaOH có đầy đủ tính chất của một hiđroxit.
+ Tác dụng với axit, oxit axit tạo thành muối và nước
NaOH + HCl → NaCl + H2O
Chú ý: Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
+ Tác dụng với oxit và hiđroxit lưỡng tính:
2NaOH + Al2O3 → 2NaAlO2 + H2O
NaOH + Al(OH)3 → NaAlO2 + 2H2O
+ Tác dụng với dung dịch muối:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 (xanh lam)
NH4Cl + NaOH → NaCl + NH3 + H2O
+ Tác dụng với một số phi kim, như halogen ...
2NaOH + Cl2 → NaCl + NaClO + H2O
+ Tác dụng với các kim loại có hiđroxit lưỡng tính như Al, Zn, Al2O3, Al(OH)3 ...
NaOH + Al + H2O → NaAlO2 + 3/2 H2
2NaOH + Al2O3 → 2NaAlO2 + H2O
NaOH + Al(OH)3 → NaAlO2 + 2H2O
3. Điều chế
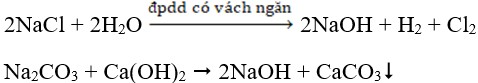
II. Natri clorua (NaCl)
1. Trạng thái tự nhiên: NaCl là hợp chất rất phổ biến trong thiên nhiên (có trong nước biển, nước của hồ nước mặn, khoáng vật halit gọi là muối mỏ).
2. Tính chất vật lí:
+ Tinh thể NaCl không có màu và hoàn toàn trong suốt.
+ Nhiệt độ nóng chảy và nhiệt độ sôi cao, tonc = 800oC, tos = 1454oC.
+ Dễ tan trong nước và độ tan không biến đổi nhiều theo nhiệt độ nên không dễ tinh chế bằng cách kết tinh lại.
+ Độ tan của NaCl ở trong nước giảm xuống khi có NaOH, HCl, MgCl2, CaCl2, ... do đó người ta thường sục khí HCl vào dung dịch muối ăn bão hòa để điều chế NaCl tinh khiết.
3. Tính chất hóa học: Khác với các muối khác, NaCl không phản ứng với kim loại, axit, bazơ ở điều kiện thường.
+ NaCl phản ứng với một muối:
NaCl + AgNO3 → NaNO3 + AgCl↓
+ Ở trạng thái rắn, NaCl phản ứng với H2SO4 đậm đặc (phản ứng sản xuất HCl, nhưng hiện nay rất ít dùng vì phương pháp tạo ra nhiều khí độc hại, gây nguy hiểm tới hệ sinh thái, ô nhiễm môi trường).
NaCl + H2SO4 → NaHSO4 + HCl
2NaCl + H2SO4 → Na2SO4 + 2HCl
+ Điện phân dung dịch NaCl:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
- Ứng dụng
+ Là nguyên liệu để điều chế Na, Cl2, HCl, NaOH và hầu hết các hợp chất quan trọng khác của natri.
+ Ngoài ra, NaCl còn được dùng nhiều trong các ngành công nghiệp như thực phẩm (muối ăn...), nhuộm, thuộc da và luyện kim.
- Điều chế
+ Người ta thường khai thác muối từ mỏ bằng phương pháp ngầm, nghĩa là qua các lỗ khoan dùng nước hòa tan muối ngầm ở dưới lòng đất rồi bơm dung dịch lên để kết tinh muối ăn.
+ Cô đặc nước biển bằng cách đun nóng hoặc phơi nắng tự nhiên, người ta có thể kết tinh muối ăn.
III. Natri hiđrocacbonat
1. Tính chất vật lý: Tinh thể màu trắng, ít tan
2. Tính chất hóa học
+ Bị phân hủy ở nhiệt độ cao: 2NaHCO3 → Na2CO3 + CO2 + H2O
+ Là chất lưỡng tính:
HCO3- + H+ → CO2 + H2O
HCO3- + OH- → CO32- + H2O
+ Dung dịch NaHCO3 có môi trường kiềm yếu:
HCO3- + H2O ↔ H2CO3 + OH-
3. Ứng dụng: NaHCO3 được dùng trong y khoa chữa bệnh dạ dày và ruột do thừa axit, khó tiêu, chữa chứng nôn mữa, giải độc axit. Trong công nghiệp thực phẩm làm bột nở gây xốp cho các loại bánh
4. Điều chế: Sục CO2 dư vào dung dịch bão hòa gồm NaCl và NH3 cùng số mol:
CO2 + H2O + NH3 → NH4HCO3
Sau đó:
NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
IV. Natri cacbonat
1. Tính chất vật lý: Natricacbonat (hay soda) là chất bột màu trắng, hút ẩm và tonc = 851oC, dễ tan trong nước và tỏa nhiều nhiệt.
2. Tính chất hóa học
+ Tác dụng với axit:
CO32- + 2H+ → CO2 + H2O
+ Thủy phân:
CO32- + H2O → OH- + HCO3- (*)
HCO3- + H2O → OH- + H2CO3 (**)
Nấc (*) mạnh hơn nhiều so với (**). Do đó Na2CO3 có tính kiềm mạnh.
+ Phản ứng trao đổi:
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
3Na2CO3 + 2FeCl3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2
3. Ứng dụng
+ Nguyên liệu trong công nghiệp sản xuất thủy tinh, xà phòng, giấy dệt và điều chế muối khác.
+ Tẩy sạch vết mỡ bám trên chi tiết máy trước khi sơn, tráng kim loại.
+ Công nghiệp sản xuất chất tẩy rửa.
4. Điều chế